TIANcombi DNS Lyse & Det PCR készlet
Jellemzők
■ Egyszerű és gyors: a különböző szövetekből származó DNS 5 perc alatt kivonható folyékony nitrogén őrlés nélkül.
■ Széles körben alkalmazható: Alkalmazható növényi levelekre, magvakra, állati szövetekre, vérmintákra (friss vér, véralvadásgátló, vérrögök, szárított vérfoltok stb.), Élesztőre és baktériumokra.
■ Erős kompatibilitás: A PCR reagens alkalmas a különböző mintaforrásokból kivont DNS amplifikálására.
Alkalmazások
■ Génészlelés: Ideális választás nagyméretű génészleléshez.
Fontos jegyzetek
■ Magas fenoltartalmú minták, például gyapotlevél esetén a minta bevitelének szigorúan kevesebbnek kell lennie, mint 0,4 mg, különben a PCR -reakció hatással lesz.
Minden termék személyre szabható az ODM/OEM számára. A részletekért,kattintson a Testreszabott szolgáltatás (ODM/OEM) lehetőségre
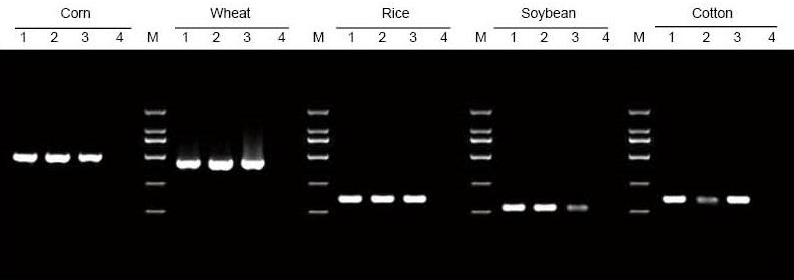 |
A DNS -t a kukorica, a búza, a rizs, a szójabab és a gyapot leveleiből és magjából 5 mg -ban extraháltuk. A DNS -t PCR -rel amplifikáltuk specifikus primerek alkalmazásával. 6 μl DNS -t töltöttünk be az összes 20 μl eluensből sávonként. 1: Pozitív kontroll genom; 2: hagyjon mintákat; 3: magminták; 4: NTC; 5: D2000 primerek |
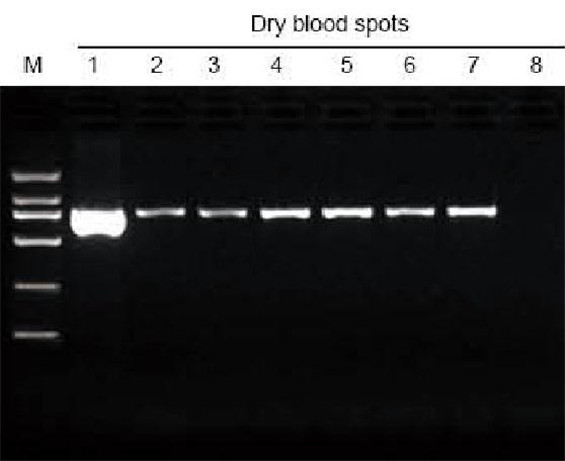 |
M: TIANGEN Marker D2000; 1: Pozitív kontroll; 2-7: A szűrőpapíron szárított vérfoltok száma 1-6; 8: Negatív kontroll. A 3 mm -es lyukasztóval a szárított vérfoltokat a szűrőpapírból vették ki az extrahálási vizsgálathoz. 6 μl DNS -t töltöttünk be az összes 20 μl eluensből sávonként. |
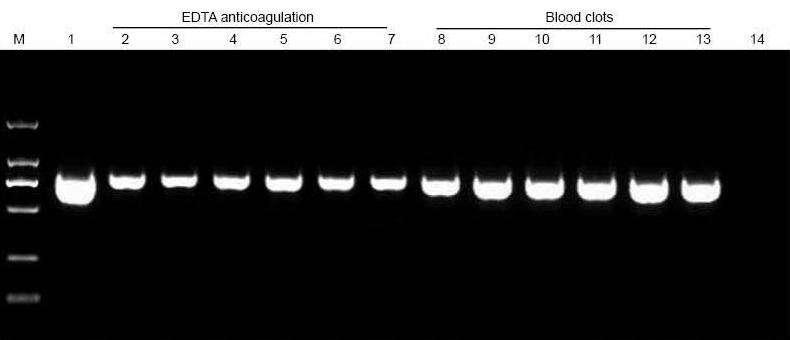 |
M: TIANGEN Marker D2000; 1: Pozitív kontroll (genomi DNS -t használtunk templátként); 2-7: A hozzáadott vér mennyisége 10 μl, 20 μl, 30 μl, 40 μl, 50 μl és 60 μl; 8-13: A hozzáadott vér mennyisége 10 μl, 20 μl, 30 μl, 40 μl, 50 μl és 60 μl; 14: NTC. Az összes 20 μl eluensből 6 μl DNS -t töltöttünk az agaróz gélre. |
A-1 sablon
■ A sablon fehérje -szennyeződéseket vagy Taq -inhibitorokat stb. Tartalmaz - Tisztítsa meg a DNS -templátot, távolítsa el a fehérje -szennyeződéseket, vagy vonja ki a DNS -t a tisztító készletekkel.
■ A sablon denaturálása nem teljes - —Megfelelően növelje a denaturálási hőmérsékletet és hosszabbítsa meg a denaturálási időt.
■ Sablonromlás-Készítse elő újra a sablont.
A-2 Alapozó
■ Rossz minőségű alapozók — Újra szintetizálja a primert.
■ Az alapozó lebomlása - A nagy koncentrációjú primereket a tartósítás érdekében kis térfogatban kell alikvotálni. Kerülje a többszörös fagyasztást és felolvasztást, vagy a tartós, 4 ° C-os fagyasztást.
■ Az alapozók nem megfelelő kialakítása (pl. Nem elegendő az alapozó hossza, dimer képződött az alapozók között stb.) -Az alapozók újratervezése (kerülje az alapozó dimer és a másodlagos szerkezet kialakulását)
A-3 Mg2+koncentráció
■ Mg2+ a koncentráció túl alacsony —— Megfelelően növelje a Mg -t2+ koncentráció: Optimalizálja a Mg -t2+ Az optimális Mg meghatározásához 1 mM -tól 3 mM -ig terjedő reakciókoncentrációval végezzük a koncentrációt2+ koncentráció minden sablon és primer esetében.
A-4 Lángolási hőmérséklet
■ A magas lágyítási hőmérséklet befolyásolja az alapozó és a sablon kötését. - Csökkentse a lágyítási hőmérsékletet, és optimalizálja az állapotot 2 ° C -os gradienssel.
A-5 Hosszabbítási idő
■ Rövid hosszabbítási idő - A hosszabbítási idő növelése.
Jelenségek: A negatív minták a célszekvencia -sávokat is mutatják.
A-1 A PCR szennyeződése
■ A célszekvencia vagy az amplifikációs termékek keresztszennyeződése - Óvatosan ne pipettázza a célszekvenciát tartalmazó mintát a negatív mintába, és ne öntse ki a centrifugacsőből. A reagenseket vagy berendezéseket autoklávozni kell a meglévő nukleinsavak eltávolítása érdekében, és a szennyeződés meglétét negatív kontroll kísérletekkel kell meghatározni.
■ A reagens szennyeződése —— A reagenseket alikvotálja és alacsony hőmérsékleten tárolja.
A-2 Primer
■ Mg2+ a koncentráció túl alacsony —— Megfelelően növelje a Mg -t2+ koncentráció: Optimalizálja a Mg -t2+ Az optimális Mg meghatározásához 1 mM -tól 3 mM -ig terjedő reakciókoncentrációval végezzük a koncentrációt2+ koncentráció minden sablon és primer esetében.
■ A primer helytelen kialakítása és a célszekvencia homológiája a nem célszekvenciával. -Újratervezett alapozók.
Jelenségek: A PCR amplifikációs sávok nincsenek összhangban a várt mérettel, legyen az nagy vagy kicsi, vagy néha mind specifikus amplifikációs sávok, mind nem specifikus amplifikációs sávok előfordulnak.
A-1 Alapozó
■ Gyenge primer specificitás
-Újratervezett alapozó.
■ A primer koncentrációja túl magas —— Megfelelően emelje a denaturálási hőmérsékletet és hosszabbítsa meg a denaturálási időt.
A-2 Mg2+ koncentráció
■ Az Mg2+ a koncentráció túl magas —— Megfelelően csökkentse az Mg2+ koncentrációt: Optimalizálja a Mg -t2+ Az optimális Mg meghatározásához 1 mM -tól 3 mM -ig terjedő reakciókoncentrációval végezzük a koncentrációt2+ koncentráció minden sablon és primer esetében.
A-3 Hőstabil polimeráz
■ Túlzott enzimmennyiség —— Csökkentse megfelelően az enzimmennyiséget 0,5 U időközönként.
A-4 Lángolási hőmérséklet
■ A lágyítási hőmérséklet túl alacsony--Megfelelően növelje a lágyítási hőmérsékletet, vagy alkalmazza a kétlépcsős hőkezelési módszert
A-5 PCR ciklus
■ Túl sok PCR ciklus - Csökkentse a PCR ciklusok számát.
A-1 Alapozó—— gyenge specifitás —— tervezze újra az alapozót, változtassa meg az alapozó helyzetét és hosszát annak fokozása érdekében; vagy végezzen beágyazott PCR -t.
A-2 sablon DNS
——A sablon nem tiszta —— Tisztítsa meg a sablont, vagy vonjon ki DNS -t tisztító készletekkel.
A-3 Mg2+ koncentráció
- Mg2+ a koncentráció túl magas —— Megfelelően csökkentse a Mg -t2+ koncentráció: Optimalizálja a Mg -t2+ Az optimális Mg meghatározásához 1 mM -tól 3 mM -ig terjedő reakciókoncentrációval végezzük a koncentrációt2+ koncentráció minden sablon és primer esetében.
A-4 dNTP
——A dNTP -k koncentrációja túl magas —- Csökkentse megfelelően a dNTP koncentrációját
A-5 Lángolási hőmérséklet
——Túl alacsony lágyítási hőmérséklet —- Megfelelően növelje a lágyítási hőmérsékletet
A-6 Ciklusok
——Túl sok ciklus ——Optimalizálja a ciklusszámot

Az első lépés a megfelelő polimeráz kiválasztása. A hagyományos Taq polimeráz nem képes lektorálni a 3'-5 'exonukleáz aktivitás hiánya miatt, és az eltérés nagymértékben csökkenti a fragmensek kiterjesztési hatékonyságát. Ezért a hagyományos Taq polimeráz nem képes hatékonyan felerősíteni az 5 kb -nál nagyobb célfragmentumokat. A speciális módosítást tartalmazó Taq polimerázt vagy más nagy pontosságú polimerázt kell választani a kiterjesztési hatékonyság javítása és a hosszú fragmentum amplifikáció igényeinek kielégítése érdekében. Ezen túlmenően, a hosszú fragmensek amplifikálása megköveteli a megfelelő primer kialakítást, denaturálási időt, hosszabbítási időt, puffer pH-t stb. A sablon károsodásának megelőzése érdekében a denaturálódási időt 94 ° C -on ciklusonként 30 másodpercre vagy kevesebbre kell csökkenteni, és a hőmérséklet 94 ° C -ra történő felemelkedésének ideje az amplifikáció előtt kevesebb, mint 1 perc. Ezenkívül, ha a kiterjesztési hőmérsékletet körülbelül 68 ° C -ra állítja, és a meghosszabbítási időt 1 kb/perc sebességnek megfelelően tervezi, akkor biztosíthatja a hosszú fragmensek hatékony amplifikációját.
A PCR -amplifikáció hibaaránya csökkenthető különböző DNS -polimerázok nagy pontosságú használatával. Az összes eddig megtalált Taq DNS -polimeráz közül a Pfu enzim a legalacsonyabb hibaarányú és a legnagyobb hűségű (lásd a mellékelt táblázatot). Az enzimszelektálás mellett a kutatók tovább csökkenthetik a PCR mutáció sebességét a reakciókörülmények optimalizálásával, beleértve a puffer összetételének optimalizálását, a hőstabil polimeráz koncentrációját és a PCR ciklusszám optimalizálását.
Termékek kategóriák
MIÉRT VÁLASSZON MIET
Megalakulása óta gyárunk az első világszínvonalú termékeket fejleszti az elv betartásával
először a minőség. Termékeink kiváló hírnévre tettek szert az iparban, és értékbecslést szereztek az új és a régi ügyfelek körében.








