FastKing gDNA Dispelling RT SuperMix
Jellemzők
■ Gyors: Egy lépés a genom eltávolításának befejezéséhez és a hatékony fordított transzkripcióhoz 18 percen belül, csak sablonok hozzáadásával.
■ Nagy hatékonyság: A reverz transzkriptázt hidrofób motívummal módosítják, az RT hatékonysága meghaladja a 95%-ot.
■ Egyszerű és könnyű: Az exkluzív hőérzékeny DNáz gyors hatást, nagy hatékonyságot és rövidebb reakcióidőt biztosít, és nem befolyásolja a cDNS -t.
Leírás
Típus: Génmódosított reverz transzkriptáz, gDNáz
Eljárások: Egy lépés (genomiális DNS-eltávolítás és RT)
RT hatékonyság: > 95%
Sablon: 1 ng- 2 μg
Működési idő: ~ 18 perc
Alkalmazások: A reverz átírt cDNS használható hagyományos PCR -ben, valós idejű PCR -ben, cDNS -könyvtár -konstrukcióban, SAGE -ban (Serial Analysis of Gene Expression), primer kiterjesztésben és más hagyományos kísérletekben.
Minden termék személyre szabható az ODM/OEM számára. A részletekért,kattintson a Testreszabott szolgáltatás (ODM/OEM) lehetőségre
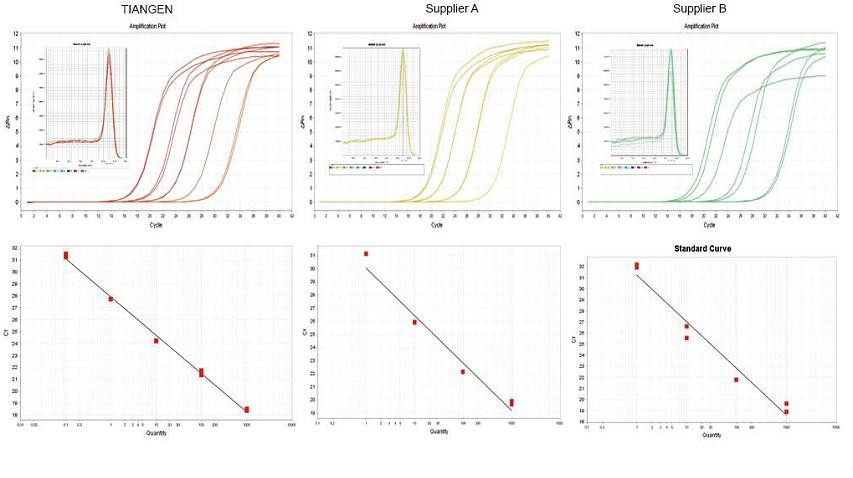 |
Kísérleti példa 1. A cDNS-t a TIANGEN FastKing gDNA Dispelling RT SuperMix egylépéses fordított kvantitatív reagensével szintetizáltuk, az A és B szállító vonatkozó termékeivel. Az egerek RN5 génjének detektálása TIANGEN Talent qPCR PreMix (SYBR Green) segítségével, és az amplifikációs görbét, olvadási görbét és standard görbét elemeztük. Az eredmények azt mutatják, hogy a TIANGEN FastKing gDNA Dispelling RT SuperMix rendelkezik a legmagasabb kvantitatív Ct értékkel a fordított transzkripció és a kiváló stresszállóság után, és nyilvánvaló előnyökkel rendelkezik a magas szennyeződéseket tartalmazó sablonok esetében. |
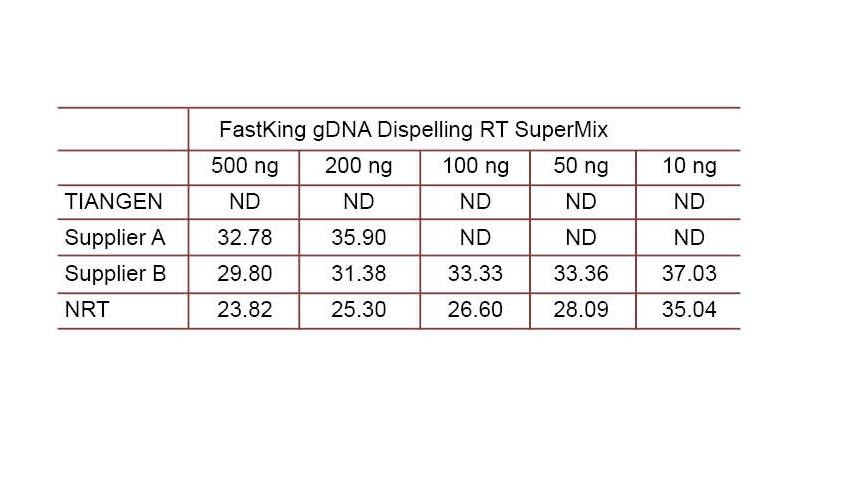 |
2. kísérleti példa A cDNS-t szintetizáltuk a TIANGEN FastKing gDNA Dispelling RT SuperMix egylépéses fordított kvantitatív reagensével, az A és a B szállító vonatkozó termékeivel. Észlelje az emberi HsG gént a TIANGEN Talent qPCR PreMix (SYBR Green) segítségével, és manuálisan adjon hozzá különböző koncentrációjú genomiális DNS -t a különböző reagensek gDNS -eltávolító képességének kimutatásához. A Ct eredmények azt mutatják, hogy a TIANGEN FastKing gDNS Dispelling RT SuperMix kiválóan képes eltávolítani a genomiális DNS -t. Akár 500 ng genomiális DNS -maradék is tökéletesen eltávolítható anélkül, hogy befolyásolná az eredményeket. ND: Nem észlelhető. NRT: A keverék kimutatása fordított transzkripció nélkül. |
Az A-1 RNS lebomlik
- Kiváló minőségű RNS tisztítása szennyeződés nélkül. Az anyagnak, amelyből az RNS -t kivonják, a lehető legfrisebbnek kell lennie, hogy megakadályozza az RNS lebomlását. Elemezze az RNS integritását denaturált gélen az RT reakció előtt. Az RNS extrakció után 100% -os formamidban kell tárolni. RNáz gátló használata esetén a hevítési hőmérsékletnek <45 ° C -nak és a pH -nak 8,0 -nál kisebbnek kell lennie, ellenkező esetben az inhibitor minden megkötött RNázt felszabadít. Ezenkívül RNáz -gátlót kell hozzáadni ≥ 0,8 mM DTT -t tartalmazó oldatokhoz.
Az A-2 RNS a reverz transzkripciós reakciók gátlóit tartalmazza
- A fordított transzkripció inhibitorok közé tartozik az SDS, EDTA, glicerin, nátrium -pirofoszfát, spermidin, formamid, guanidin -só stb. Az inhibitorok eltávolítása érdekében az RNS -kicsapást 70% (v/v) etanollal mossuk.
A-3 A cDNS első szálának szintetizálásához használt primerek elégtelen lágyítása
- Határozza meg, hogy a lágyítási hőmérséklet megfelelő -e a kísérletben használt primerekhez. Véletlenszerű hexamerek esetén ajánlott a hőmérsékletet 10 percig 25 ° C -on tartani, mielőtt elérné a reakció hőmérsékletét. Génspecifikus primerek (GSP) esetén próbálkozzon más GSP-vel, vagy váltson oligo (dT) vagy véletlenszerű hexamerre.
A-4 Kis mennyiségű kiinduló RNS
- Növelje az RNS mennyiségét. 50 ng -nál kisebb RNS -minták esetén 0,1 μg -0,5 μg acetil -BSA használható az első szál cDNS -szintézisben
A-5 A célszekvencia nincs kifejezve az elemzett szövetekben.
- Próbálja ki a többi szövetet.
Az A-6 PCR reakció sikertelen
—— Kétlépéses RT-PCR esetén a PCR lépésben a cDNS-sablon nem haladhatja meg a reakciótérfogat 1/5-ét.
A-1 Alapozók és sablonok nem specifikus lágyítása
——A primerek 3'-végén nem lehet 2-3 dG vagy dC. Használjon génspecifikus primereket az első szál szintézisében véletlenszerű primerek vagy oligo (dT) helyett. Az első néhány ciklusban használjon magasabb, majd alacsonyabb hőkezelési hőmérsékletet. A reakció specifikusságának javításához használjon PCR-hez forróindítású Taq DNS-polimerázt.
A-2 Génspecifikus primerek rossz tervezése
—–Kövesse ugyanazokat az elveket az amplifikációs primer tervezésnél.
Genomikus DNS-sel szennyezett A-3 RNS
——Az RNS kezelése PCR-minőségű DNáz I-vel. Állítson be kontrollreakciót reverz transzkripció nélkül a DNS-szennyeződés kimutatására.
A-4 Primer dimer képzése
—— Tervezzen olyan primereket, amelyek komplementer szekvenciákat nem tartalmaznak a 3 'végén.
A-5 Túl magas Mg2+ koncentráció
- Optimalizálja a Mg -t2+ koncentráció minden sablon és primer kombináció esetén
A-6 Idegen DNS-sel szennyezett
—— Használjon aeroszolálló csúcsokat és UDG enzimeket.
A-1 Az első szál termék tartalma túl magas
- Csökkentse az első szál termék mennyiségét a hagyományos PCR reakció lépésben.
A-2 Túl magas primer mennyiség a PCR reakcióban
- Csökkentse a primer bevitelét.
A-3 Túl sok ciklus
—— Optimalizálja a PCR reakciókörülményeket és csökkentse a PCR ciklusok számát.
A-4 Túl alacsony hőkezelési hőmérséklet
-Növelje a hőkezelési hőmérsékletet, hogy megakadályozza a nem specifikus beindítást és kiterjesztést.
A-5 Az oligonukleotid fragmensek nem specifikus amplifikációja, amelyet a DNS DNáz lebontása generál-Kivonjon kiváló minőségű RNS-t a DNS-szennyeződés megakadályozása érdekében.
Az RT-PCR azt jelenti, hogy az RNS-t reverz átírja cDNS-be, majd a reverz átírt cDNS-t sablonként használja a PCR-reakcióhoz a célfragmens amplifikálásához. Válasszon véletlenszerű primereket, Oligo dT és génspecifikus primereket a kísérlet sajátos körülményeinek megfelelően. A fenti primerek mindegyike használható rövid eukarióta sejt mRNS -hez hajtű szerkezet nélkül.
Véletlenszerű primer: Alkalmas hosszú RNS-hez hajtűszerkezettel, valamint mindenféle RNS-hez, például rRNS-hez, mRNS-hez, tRNS-hez stb.
Oligo dT: Alkalmas RNS -hez PolyA farokkal (prokarióta RNS, eukarióta Oligo dT rRNS és tRNS nem rendelkezik PolyA farokkal). Mivel az Oligo dT a PolyA farokhoz van kötve, az RNS minták minőségének magasnak kell lennie, és még egy kis mértékű lebomlás is nagymértékben csökkenti a teljes hosszúságú cDNS szintézis mennyiségét.
Génspecifikus primer: kiegészíti a sablon szekvenciát, alkalmas olyan helyzetekre, ahol a célszekvencia ismert.
Két módja van:
1. Belső referencia módszer: Elméletileg a cDNS különböző hosszúságú DNS -töredékek, így az elektroforézis eredménye kenet. Ha az RNS -bőség alacsony, egyetlen termék sem jelenik meg elektroforézisben, de ez nem jelenti azt, hogy egyetlen termék sem amplifikálódik PCR -rel. Általában a belső referencia használható a cDNS kimutatására. Ha a belső referenciának vannak eredményei, akkor alapvetően garantálni lehet a cDNS minőségét (néhány esetben, ha a célgén -fragmentum túl hosszú, kivételek lehetnek).
2. Ha van egy ismert gén, amelyet ez a sablon felerősített, akkor ennek a génnek a primereivel ellenőrizhető. A belső referencia erősítése nem feltétlenül jelenti azt, hogy nincs probléma a cDNS -sel. Mivel a belső referencia nagy mennyiségben tartalmaz cDNS -t, könnyen erősíthető. Ha a cDNS különböző okok miatt részben lebomlik, akkor a valószínűség szempontjából nagy hatással lesz az alacsony bőségű célgének PCR -eredményeire. Míg a belső referencia még mindig nagy mennyiségű, az erősítést valószínűleg nem befolyásolja.
Részben lebontja az RNS -t. Az RNS integritásának észlelése és tisztítása
A különböző fajok RNS -tartalma eltérő lehet, de általában a kivont teljes RNS -nek két tiszta 28S és 18S sávot kell tartalmaznia gélelektroforézisben, és az előbbi sáv fényerejének kétszer akkoranak kell lennie, mint az utóbbinak. Az 5S sáv azt jelzi, hogy az RNS lebomlott, és fényessége arányos a lebomlás mértékével. A belső referencia sikeres felerősítése nem jelenti azt, hogy nincs probléma az RNS -sel, mivel a belső referencia nagy mennyiségben található, az RNS amplifikálható mindaddig, amíg a lebomlás nem súlyos. Az OD260/OD280A tiszta RNS spektrofotométerrel mért arányának 1,9 és 2,1 között kell lennie. Egy kis mennyiségű fehérje szennyeződés az RNS -ben csökkenti az arányt. Amíg az érték nem túl alacsony, az RT nem lesz hatással. Az RT szempontjából a legfontosabb az RNS integritása.
A belső referenciagén kiterjesztése csak azt jelezheti, hogy az RT sikerült, de nem feltétlenül függ össze a cDNS -szál minőségével. Mivel a belső referenciafragmensek általában kis méretűek és magas expressziójúak, könnyebben sikeresek lehetnek a fordított transzkripcióban. A célgén mérete és expressziója azonban génenként változik. A cDNS minőségét nem lehet csak belső referenciával megítélni, különösen a 2 kb -nál hosszabb célfragmensek esetében.
Egyes minták összetett másodlagos struktúrával rendelkeznek, vagy gazdag GC -tartalommal rendelkeznek, vagy értékesek, alacsony mennyiségben. Ezekben az esetekben a megfelelő reverz transzkriptázt kell kiválasztani a célfragmens és a minta méretének megfelelően. A magas GC -tartalmú és bonyolult másodlagos szerkezetű RNS -sablonok esetében nehéz a másodlagos szerkezetet alacsony hőmérsékleten vagy közös reverz transzkriptázzal megnyitni. Ezekhez a sablonokhoz a Quant Reverse Transcriptase választható ki, mivel fordított transzkripciós teljesítménye nyilvánvalóan jobb, mint az M-MLV sorozatú reverz transzkriptázé, amely hatékonyan képes visszafordítani különböző RNS-sablonokat, és az RNS-t a maximális mértékben átírhatja a cDNS első szálába. Általános reverz transzkriptáz készlet használata esetén a 20 μl -es rendszer csak 1 μg teljes RNS -t képes hatékonyan visszafordítani. Kérjük, ügyeljen a készlet maximális RT -kapacitására. Ha a templátot túlzott mértékben adjuk hozzá, a reverz transzkripció előnyben részesíti az RNS -t nagy mennyiségben. Ezért jobb, ha nem lépi túl a rendszer maximális kapacitását.
A-1 Határozza meg, hogy az RNS súlyosan lebomlott-e, és hogy az RT sikeres-e
Általában a belső referencia -amplifikáció sikertelenségének oka gyakran az RNS súlyos lebomlása. Egy másik lehetséges ok a fordított transzkripció meghiúsulása. A belső referencia nem használható standardként az egyetlen cDNS szál minőségének megítélésére, de standardként használható annak megítélésére, hogy sikeres -e a reverz transzkripció, ha nincs probléma az RNS minőségével. A fordított transzkripciós folyamatban a legfontosabb az állandó hőmérséklet és az állandó reakciórendszer fenntartása a reakció hatékonyságának javítása érdekében.
A-2 Határozza meg, hogy a belső referenciagének amplifikálására szolgáló primerek megbízhatóak-e, és vannak-e problémák a PCR-ben használt reagensekkel.
A relatív mennyiségi meghatározáshoz az RNS -t számszerűsíteni kell a reverz transzkripció előtt, ami sok fordított transzkripciós készletben is szükséges, például az RNS bemenetet 1 μg -ban kell meghatározni. Mivel a reverz átírt cDNS vegyes oldat, beleértve az RNS -t, az oligo dT -t, az enzimet, a dNTP -t és még egy kis DNS -maradékot is, eltérést okoz, ezért lehetetlen pontosan meghatározni a cDNS -t. Ezért szükséges az RNS mennyiségi meghatározása. Tekintettel arra, hogy a fordított transzkripció hatékonysága azonos a különböző minták között, a kapott cDNS mennyiségének azonosnak kell lennie, és a kvantitatív elemzés megmutathatja a különböző gének expressziós szintjének összehasonlítását azonos mennyiségű teljes RNS -ben. Relatív fluoreszcencia kvantitatív PCR végrehajtásakor előfordulhat, hogy a reverz transzkripció után nincs szükség kvantitatív cDNS -re, mivel a belső referenciagén referenciaként működhet.
Főleg a génekhez kapcsolódik, és a hosszú fragmens fordított transzkripciója a legtöbb gén esetében nem megvalósítható. Először is, a reverz transzkripció hatékonysága jóval alacsonyabb, mint a PCRé. Másodszor, a GC -ben gazdag régió és sok gén másodlagos szerkezete korlátozza mind a reverz transzkripciót, mind a PCR -t. Végül a PCR hűségét és amplifikációs hatékonyságát nehéz egyszerre garantálni. A fordított transzkripció folyamatában senki sem tudja garantálni, hogy hosszú fragmentumot kap az alacsony kópiaszámú génekhez, különösen az oligo dT használatával. Ami az 5 'UTR -t, több GC -vel, még nehezebb. Ezért továbbra is ésszerű módszer véletlenszerű primerekkel megfordítani az átiratot, megkeresni a természetes hasítási helyeket a célfragmensben, szegmensekkel amplifikálni, majd elvégezni a restrikciós emésztést és a ligálást. Általában nehéz közvetlenül amplifikálni a 2 kb -nál nagyobb fragmentumokat, de nem mindig lehetetlen megszerezni: 1. Először is garantálni kell az RNS/mRNS integritását, és előnyös a TRIZOL extrakció. 2. Az M-MLV RT-PCR készlet közvetlenül használható. Hosszabbítsa meg a lágyítási időt és növelje a ciklusszámot az erősítési folyamat során. Alternatív megoldásként beágyazott PCR alkalmazható, vagy először egy vagy két reakciót hajthat végre megfelelően meghosszabbított denaturációval és hosszabbítási idővel a normál PCR -amplifikáció előtt, ami segíthet a fragmentumok meghosszabbításában. Ügyeljen a polimeráz hűségére. 3. A Long Taq használható PCR -ben az ideális eredmények eléréséhez. 4. A fehérje expressziós alkalmazásához nagy pontosságú polimerázt kell alkalmazni.
A TIANGEN kétféle reverz transzkriptázt kínál: Quant/King RTase és TIANScript M-MLV. A fő különbség közöttük a sablonok beviteli mennyisége. A Quant egyedülálló reverz transzkriptáz, amely eltér a Moloney egér leukémia vírusból származó, általánosan használt M-MLV-től. A Quant egy új, nagy hatékonyságú reverz transzkriptáz, amelyet a mérnöki Escherichia coli rekombináns módon expresszál. A Quant alkalmas 50 ng-2 μg RNS amplifikálására, magas fordított transzkripciós aktivitással és nagy hozammal. A közönséges MMLV -hez vagy AMV -hez képest a Quant legnagyobb jellemzője, hogy nagyon erős affinitása van az RNS -sablonokkal, és képes visszafordítani a transzkripciós komplex sablonokat magas hőmérsékletű denaturáció nélkül. A magasabb GC -tartalmú sablonok esetében a fordított hatékonyság magasabb. Ennek a reverz transzkriptáznak azonban RNáz H aktivitása van, ami befolyásolhatja a cDNS termék hosszát (alkalmas <4,5 kb -s templátokhoz). A hagyományos reverz transzkripcióhoz TIANScript MMLV reverz transzkriptáz ajánlott. Ez az RTáz egy nagyon gyenge RNáz H aktivitással rendelkező módosított enzim, amely alkalmas hosszú (> 5 kb) cDNS szintézisre.
Az egylépéses reverz transzkripciót és a PCR-amplifikációt ugyanabban a csőben fejezzük be anélkül, hogy a cDNS-szintézis és az amplifikáció között kinyitnánk a csőfedelet, ami segít csökkenteni a szennyeződést. Mivel az összes kapott cDNS mintát amplifikációra használják, az érzékenység magasabb, legalább 0,01 pg teljes RNS. A sikeres egylépéses RTPCR-hez általában génspecifikus primereket használnak a cDNS szintézis elindításához. A kétlépéses módszert, nevezetesen a reverz transzkripciót és a PCR amplifikációt két lépésben hajtjuk végre. Először reverz transzkripciót hajtunk végre egy RNS -templátból, hogy cDNS -t kapjunk, és a kapott cDNS -t egy vagy több különböző PCR -reakciónak vetjük alá. A kétlépéses módszer oligo (dT) vagy random primereket használhat a cDNS első szálának szintézisének irányításához, és megfordíthatja egy adott mintából származó összes mRNS információt.
Termékek kategóriák
MIÉRT VÁLASSZON MIET
Megalakulása óta gyárunk az első világszínvonalú termékeket fejleszti az elv betartásával
először a minőség. Termékeink kiváló hírnévre tettek szert az iparban, és értékbecslést szereztek az új és a régi ügyfelek körében.